Вода - электролит или нет?
Электролиты - это вещества (преимущественно минеральные соединения), которые способны проводить электрический ток. Их электроны имеют положительный или отрицательный заряд. В человеческих организмах электролиты в виде растворов солей разной концентрации находятся в крови и тканях. Они расщепляют пищевые продукты, доставляют в клетки питательные вещества, выводят из них продукты распада, регулируют обмен веществ, поддерживают водный баланс и баланс щелочности/кислотности. Рассмотрим: вода - это электролит или нет, может ли вода быть электролитом и при каких условиях, вода - это слабый или сильный электролит?
Является ли вода электролитом
Электрический ток представляет собой упорядоченное движение частиц. Сила тока - количество электронов, способных перемещаться через определенное вещество. Скорость их перемещения зависит от структуры вещества. Но не все химические составы являются электролитами.
Из-за способности или неспособности природных веществ и химических соединений проводить ток в водном растворе или расплаве их можно отнести к электролитам или неэлектролитам:
- электролиты - соли, кислоты, основания хорошо проводят электрический ток из-за полярной связи;
- неэлектролиты - амины, спирты, углеводы не являются проводниками электротока, потому что в молекулах неэлектролитических веществ неполярные или низкополярные связи.
Проводимость электролитических растворов зависит от электролитической диссоциации - способности молекул распадаться на ионы при расплавлении или растворении в воде. При распаде они образуют два вида ионов:
- катионы - с зарядом плюс (+);
- анионы - с зарядом минус (-).
Ионы, находящиеся в воде и связанные с Н2О, являются гидратированными.
По способности к диссоциации электролиты могут быть:
- сильными - они полностью распадаются на катионы и анионы, степень диссоциации свыше 30%;
- средними по силе распада - 3-30%;
- слабыми - частично распадаются, диссоционный процесс идет не до конца, степень диссоциации менее 3%.
К сильным электролитам относятся:
- все соли (морская вода как сильный электролит отлично проводит электроток);
- кислоты - хлорноватистая HClO, хлорная HCl, азотная HNO, серная H2SO4;
- щелочи различных веществ - натрия NaOH, лития LiOH, калия KOH.
Слабые электролиты в воде - это малорастворимые гидроксиды металлов, все органические и часть неорганических кислот.
В таблице ниже отображена способность некоторых химических веществ и соединений (кислот, щелочей и солей) к электролитической диссоциации (таблица растворимости). 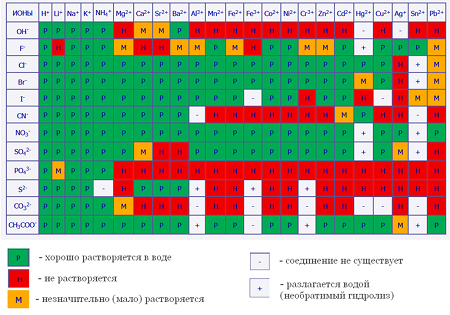
Почему вода не электролит
В чистом виде молекула Н2О нейтральна: в ней содержатся катионы-анионы водорода и кислорода, но нет свободных радикалов.
Это диэлектрик, который не может проводить электричество - у него:
- низкая электропроводность - менее 5 мкСм/см;
- удельное сопротивление - до 18 МОм*см (у сверхчистой жидкости).
Деминерализованная, дистиллированная, деионизированная вода не является электролитом (относится к неэлектролитам). В ней нет веществ, способных проводить электрический ток.
Проблема в том, что идеально чистой Н2О в природе очень мало. Такую жидкость можно получить искусственно лишь после полной очистки от примесей - убрав сторонние вещества, которые в ней растворены. Но она хранится недолго. При негерметичной упаковке в нее вновь попадают различные вещества из окружающей среды - происходит вторичное загрязнение, усиливается электропроводимость.
Почему вода - это электролит
Чистой считается лишь вода ледников. В реках, озерах, в подземных залежах нет чистой Н2О. В водном растворе присутствует железо и тяжелые металлы, минеральные соли, газы и иные вещества. Сухие соли не проводят электричество, но их растворы, в зависимости от концентрации, становятся сильными, средними или слабыми электропроводниками.
При попадании в воду молекулы обычной пищевой соли NaCl распадаются на катионы натрия Na+ и на анионы хлора Cl-, которые взаимодействуют с водородом и кислородом.
Даже очищенная до нормативных параметров обычная водопроводная вода, текущая из крана, хорошо проводит электрический ток - она электролит. Присутствие в ней солей выдает накипь на нагревательных элементах и на дне посуды, осадок при отстаивании, каменистые ободки вокруг кранов, потеки на сантехнике.
Таким образом: большая часть природной воды и даже жидкость, поступающая потребителям после централизованной водоочистки от загрязнений, это не диэлектрик, а электролит, способный проводить электричество. Присутствие солей, кислот или щелочей к воде в соотношении 35:65 превращает ее в сильное электролитическое вещество.
Как в водоподготовке и водоочистке используют электролитические свойства воды
При чрезмерной концентрации солей вода, как сильный электролит, характеризуется высокими показателями электропроводности. Ее нельзя применять в лабораториях, микроэлектронике, химической промышленности, в быту. Нельзя заливать в аккумуляторы, использовать в технологических процессах, разбавлять антифризы и прочие рабочие жидкости.
При очистке водных растворов от солей используют некоторые специальные методы с учетом того, вода - это хороший электролит.
1. Ионообменная очистка. В водных растворах за счет вступления веществ в химические реакции, происходит ионный обмен - электролиты обмениваются ионами. На этой способности основан ионообменный метод очистки воды от загрязнений. В качестве фильтрационных элементов применяют специальные каталитические сорбционные загрузки и сложные смеси ионообменных смол. За счет натрий-водородного катионирования и ионного обмена между катионами/анионами воды и растворенных в ней веществ происходит замещение: из воды извлекается железо, кальций, магний, газы и органические вещества. Для восстановления ресурса ионообменных смол их насыщают раствором соли NaCl, который дозированно подают из солевого бака.
2. Электролиз. Это безреагентный способ очистки воды и стоков - без применения хлора, озона и прочих сильных окислителей. Через водный раствор с двумя электродами (катодом и анодом) пропускают электрический ток. Положительно заряженный электрод притягивает отрицательно заряженные частицы (анионы), а положительно заряженные катионы стремятся к аноду. Загрязняющие вещества, извлекаемые из воды под действием тока, осаждаются на электродах.
Способ применяют для очистки воды в бассейнах, аквапарках, дельфинариях. Так очищают воду для подачи в системы отопления. Установки-электролизеры недорогие. Нет трат на покупку реагентов. Не нужны дозирующие устройства и реагентные баки для ввода реагентов в систему водоочистки.
3. Электродеионизация. В основе деионизационных установок EDI лежит принцип диссоциации воды как электролита и метод электролиза (электродиализа). Под действием тока и электромагнитного поля катионы и анионы движутся к «своим» электродам - к аноду или катоду. Во время упорядоченного движения заряженные частицы проходят через обратноосмотические мембраны и смолы.
При такой очистке не используют реагенты, нет опасных отходов. Примеси, осаждающиеся на мембранах, смоле, электродах, автоматически смываются в канализацию. Деионизированную воду в больших количествах расходуют: медицина и фармацевтика, гальваническая отрасль, промышленные предприятия энергетики, нефтехимии, полупроводниковых приборов.
Купить оборудование для водоочистки в компании «Диасел»
Мы комплектуем установки водоочистки с применением качественных ионообменных смол Экотар/Экомикс.
Дополняем их:
- солевым баком, емкость которого пропорциональна объему фильтрующей загрузки;
- дозирующим устройством для подачи точного количества раствора;
- насосной станцией, которая обеспечивает нужное давление;
- смолой и таблетированной солью для регенерации смолы.
Скомплектуем уникальную EDI-установку MicroCell, которая производит глубокую водоочистку. Катионы и анионы, двигаясь навстречу друг другу, не могут пройти через ионообменную мембрану и попадают в концентрат. Из установки выходит деионизированная вода, которая уже не относится к электролитам, ее электропроводность не превышает минимально допустимые показатели.
Установки обратного осмоса также производят качественную очистку. Даже относительно чистая водопроводная вода все равно проводит электрический ток, а после обратноосмотической деминерализации она из электролита превращается в неэлектролит.
Консультанты нашей компании подберут лучшее оборудование с нужной производительностью.












